2014年全球结核病报告(摘编)- 续八
时间:2015-05-07
第九章 研究与发展
2015年后的全球结核病策略的目标是终止全球结核病的流行。尽管自二十世纪九十年代中期以来,在结核病预防、诊断和治疗方面已取得了极大进展,但要实现这一目标仍需要技术研发的突破。关键的技术包括三类:经济上可负担的、短期、有效且可耐受的结核治疗(包括潜伏感染、药物敏感结核病和耐药结核病等各种形式的结核病),可对最重要的抗结核药物耐药性进行即时检测的诊断技术,有效的结核疫苗。
一、新诊断技术
(一)新诊断技术的研发进展状况
WHO对评价结核病新诊断技术的5个阶段提出了明确的证据需求,在这一诊断技术的研发计划中,仍缺乏包括儿童结核病诊断、新化疗方案中所包含的药物的敏感性评价、预测潜伏感染进展为活动性结核病、患者治疗监测中痰培养的替代方法等技术。
截止2014年8月,全球的结核病新诊断技术整体研发和应用进展,可分为以下几类:
1. WHO推荐的新技术
(1)分子检测技术:包括两种技术,为可以检测肺结核、肺外结核和儿童结核的Xpert MTB/RIF技术,和可以检测结核分枝杆菌和利福平耐药的线性探针技术。
(2)显微镜检查技术:包括光学和半导体发光二极管显微镜检查技术、当日诊断技术。
(3)以培养为基础的技术:包括商业化的液体培养系统和、非商业化的培养和DST技术(MODS、NRA和CRI)。
2. WHO已评估、但尚未推荐的新技术
包括两类:血清学诊断技术、检测活动性结核病的γ-干扰素释放试验。
3. 已上市、但WHO未进行评估的新技术
主要是分子技术,包括iCubate 系统(美国)、TB 耐药检测(Capital 生物公司,中国)、EasyNAT TB诊断试剂盒(中国)和Truelab/Truenat MTB (印度)。
4. 2015年WHO将进行评价的诊断技术
(1)分子技术:
1)TB-LAMP(Eiken,日本)技术:采用分子技术在痰标本中检测TB的DNA,以替代痰涂片镜检。
2)分子DST方法(Hain Lifescience MTBDR sl): 检测氟喹诺酮类和二线注射剂的耐药性,以替代传统药敏试验。
3)线性探针技术
(2)非分子技术
主要是Urinary LAM(Alere,美国)技术,在免疫系统严重受损人群中检测活动性结核。
5. 处于早期研发阶段的新技术
主要覆盖以下领域:与有机化合物相关的技术、分子技术、以培养基基础的技术、以及其他新的研发技术。
(二)新的诊断技术需求
诊断工具生产厂商需要掌握其产品的市场需求和市场规模,因此,确定目标产品框架(TPPs)是将终端用户的市场需求与产品研发者目标进行综合考虑的重要步骤。目标产品框架包括以下内容:
1. 可检测所有类型结核病的非痰标本即时诊断技术
目前最急需的检测技术之一是采用非痰标本(如:尿、血液、口腔黏膜分泌物、唾液、呼出的气体)检测肺结核、肺外结核,并可确定是否可启动治疗或当天即可明确诊断。
2. 即时类选检测技术
需要一种简单的、低成本的检测技术,区分结核病患者和尚未患病但需进行进一步诊断的人群,这样可减少需进行结核病检测的人数并降低成本。
3. 可替代显微镜检查、基于痰标本的结核分枝杆菌快速检测技术需要一种快速、敏感、易操作的痰标本检测技术来替代显微镜涂片检查,以提高患者发现和治疗水平、减少传播,同时可实现早期诊断、降低病死率。
4. 可在镜检中心进行新一代DST
至少应可检测利福平、氟喹诺酮(包括莫西沙星)、异烟肼和吡嗪酰胺、二线注射剂(氨基糖甙类和卷曲霉素)的耐药状况。
二、抗结核药品
目前在抗结核治疗中应用的药物已问世40余年,一线药物治疗疗程为6个月,耐多药肺结核疗程更长(绝大部分患者需要采用二线抗结核药物治疗至少20个月),这与严重的副反应和低治愈率有关。在抗结核药品领域,目前需要缩短疗程和简化治疗的新药、改善MDR-TB治疗的有效性和耐受性的新药、改善TB/HIV双感患者治疗的新药。
总体上,截止2014年8月底,10种新药或重组药物处于Ⅱ或Ⅲ期临床试验,1种药物(利福喷汀)同时处于Ⅱ期和Ⅲ期临床试验中。
1. 对敏感结核病的治疗
(1)化疗方案中包含氟喹诺酮的2个临床试验:均采用4个月疗程,于2013年完成了Ⅲ期临床试验。
1)OFLOTUB:采用加替沙星(400mg/天,每日服药)替代乙胺丁醇,组成化疗方案(2RHGZ/2GRH),在5个非洲国家随机选择1836例患者进行临床试验,观察终点是不良的结局,包括治疗失败、复发、死亡和退出。
结论:该方案并不优于WHO推荐的标准化疗方案。
2)ReMOX:采用莫西沙星替代乙胺丁醇或异烟肼,组成两个化疗方案,即:17周的利福平、异烟肼和莫西沙星,前8周增加吡嗪酰胺;17周的利福平和莫西沙星,前8周增加吡嗪酰胺和乙胺丁醇。以26周的利福平和异烟肼(前8周增加乙胺丁醇和吡嗪酰胺)方案作为对照,在9个国家共50个研究地区中随机抽取的1931例患者中进行非劣效性比较。
结论:对照组的治疗结局优于新方案组,不良反应方面无差异。
(2)既往的2个评估普通结核患者化疗方案的临床试验结果显示,在强化期用莫西沙星替代异烟肼或在继续期采用利福喷汀,这些方案的耐受性较好;在强化期采用利福喷汀每周1次(1200mg)和莫西沙星的6个月方案并不劣于目前推荐的6个月方案,但是,强化期每周2次利福喷汀(900mg)和莫西沙星的4个月方案疗效明显劣于目前推荐的6个月方案。
(3)结论:
综合关于莫西沙星的临床试验结果,可得到如下结论:不推荐在非复杂性的涂阳肺结核患者中使用含莫西沙星的4个月方案,采用第三代的氟喹诺酮替代乙胺丁醇或异烟肼并不能将疗程缩短2个月。
2. 关于利福喷汀的研究
对利福喷汀的研究,由于其研究目的的不同,目前同时在进行Ⅱ期和Ⅲ期临床试验。
(1)评价利福喷汀是否可缩短药物敏感性结核病的疗程
1)TBTC Study 29:在涂阳患者中以标准化疗方案作为对照,评价利福平10mg/kg或利福喷汀10mg/kg(均为每周5天给药)两种方案(均不给予膳食指导)治疗2个月后的痰培养阴转情况,目前仍处于Ⅱ期临床试验阶段。
初步结论:这两个方案不能显著提高阴转率,但安全性和耐受性较好。
2)TBTC Study 29X:于2011年和2012年纳入334例涂阳肺结核患者,评价异烟肼、丙嗪酰胺、乙胺丁醇分别与利福平10mg/kg或利福喷汀10mg/kg、15mg/kg、20mg/kg(均为每周7天给药)组成的化疗方案。
结论:安全性和耐受性较好,利福喷汀每日用药是否可缩短疗程,还需进一步开展研究。
(2)研究高剂量利福喷汀每日用药是否可提高药物浓度
l A5311:由NIH/ACTG进行的Ⅰ期研究。纳入44名健康志愿者,评价利福喷汀20mg/kg每日1次给药方案、利福喷汀10mg/kg每日2次给药且补充1个鸡蛋或低脂早餐对患者体内药物浓度的影响。结果显示两次给药和给予鸡蛋壳显著提高药物浓度。
(3)利福喷汀每日用药治疗活动性结核病的疗效
这两个Ⅱ期临床试验均2013年完成,均采用中度剂量的利福喷汀(7.5-10mg/kg)。
1)RioMAR:该临床试验在巴西进行,分别由NIAID和TBTC支持。该试验纳入121例成年涂阳肺结核患者,随机分配至两个化疗方案组,一组为利福喷汀7.5mg/kg/天+莫西沙星400mg/天+异烟肼+丙嗪酰胺(PMHZ),另一组为利福平10mg/kg/天+乙胺丁醇+异烟肼+丙嗪酰胺(REHZ)。结果显示:前一方案具有安全性和可耐受性,且在强化期末的痰培养阴转率显著高于后一方案。
2)另一临床试验在南非开普敦进行,评价了在强化期采用利福喷汀450mg/天或利福喷汀600mg/天或利福平600mg/天治疗涂片阳性且药物敏感的结核病成年患者的效果和安全性。结果显示:利福喷汀在这一剂量上具有安全性和可耐受性,600mg剂量比450mg剂量具有更好的效果。
(4)TBTC Study 31:这一试验还未启动,计划于2015年上半年开始纳入,样本量为2400例患者。将比较两个利福喷汀每日给药的4个月方案对于药物敏感性结核病患者的治疗效果。这两个方案为:在强化期,采用异烟肼、丙嗪酰胺、乙胺丁醇联合利福喷汀20mg/kg,或异烟肼、丙嗪酰胺、莫西沙星联合利福喷汀20mg/kg,两个方案均为每周7天给药,并联合膳食干预;在继续期,前一方案为异烟肼+利福喷汀,后一方案为异烟肼+莫西沙星+利福喷汀
3. 儿童结核的治疗
STEP-TB项目:由结核病药物发展全球联盟、WHO全球结核病项目和药物与健康产品部发起,由UNITAID资助,目的是加速儿童结核的治疗工作和终止儿童的流行。
4. 治疗MDR-TB 的新药物
(1)贝达喹啉:
l 2012年12月,美国FDA批准其用于MDR-TB治疗
l 2013年6月,WHO出版关于贝达喹啉在MDR-TB治疗中的使用规范
l 2014年4月,欧洲(EMA)批准在成年MDR-TB患者中使用
l 评价其安全性和有效性的Ⅱ期临床试验已经完成,另一个评价其在MDR-TB治疗9个月方案和6个月方案中的安全性和有效性的Ⅲ期临床试验计划于2014年底启动,这一临床试验将被包含在STREAM试验中进行。
(2)Delamanid(OPC-67683):处于Ⅲ期临床试验阶段,2013年已纳入500例患者,预计2016年完成。这一试验是评价Delamanid +OBR 6个月给药的疗效。
(3)评价Delamanid +OBR对儿童MDR-TB的治疗效果
已开展了2个临床试验,预计将于2017年完成。
1) PK 研究:评价Delamanid +OBR的药代动力学。
2) Trial 242-12-233:评价Delamanid +OBR6个月方案的安全性、可耐受性、药代动力学、有效性
5. 新的药物敏感和/或耐药结核化疗方案
均处于Ⅱ期临床试验,包括:
(1)NC-002:评估莫西沙星+吡嗪酰胺+PA-824(Pa-M-Z)方案的有效性、安全性和可耐受性。纳入新诊断的药物敏感性或涂片阳性的MDR-TB成年患者,采用两种剂量的PA-824(100mg和200mg)治疗8周,检测固体培养基上的CFU的改变率。结果显示:这一方案对药物敏感性结核和MDR-TB均有杀菌活性,且这一杀菌活性明显优于HRZE方案。
(2)NC-003:评估氯苯吩嗪、贝达喹啉、PA-824和吡嗪酰胺组成的化疗方案对药物敏感结核的疗效。这一试验纳入了105例新诊断的涂阳肺结核患者,对7个方案治疗后0-14天中不同时间的CFU进行了比较。采用的7种方案为:HRZE、单独用氯苯吩嗪、单独用丙嗪酰胺、贝达喹啉+PA-824+Z、贝达喹啉+PA-824+Z+氯苯吩嗪、贝达喹啉+PA-824+氯苯吩嗪、贝达喹啉+ Z+氯苯吩嗪。结果显示:PA-824+贝达喹啉+ Z具有较强的杀菌活性,应进行更长时间的观察;氯苯吩嗪并未显示出杀菌活性。
(3)MAMS-TB-01:由EDCTP资助并由PanACEA实施,该试验评估由异烟肼、利福平、吡嗪酰胺、乙胺丁醇、莫西沙星和SQ-109组成的3个月的化疗方案的疗效,其评价终点是液体培养的阴转率。这一试验于2013年5月启动,2014年3月由IDMC进行了安全性和有效性的评价,结果显示:没有足够的证据显示这些方案可以缩短疗程,但同时也没有证据显示这些方案劣于标准化疗方案。
6. 潜伏感染治疗
(1)Study 26:2011年发布了研究结果,每周一次12个剂量单位的H/P组与对照组效果相似。同时,该试验的研究者也发布了结果,在2-18岁的儿童潜伏感染者和13岁以上没有接受抗病毒治疗的HIV感染者中,该方案的效果并不低于对照组。
(2)Trial A5279:2012年5月启动,至2014年7月,该试验纳入2075人(样本量为3000人),采用异烟肼300mg+利福喷汀600mg每日给药30天方案,与异烟肼300mg每日给药9个月方案向对比。
三、结核疫苗
全球结核病疫情的缓慢下降和MDR-TB疫情的增长,显示需要新的有效的结核疫苗。预防结核病的卡介苗(BCG)已经问世近100年,虽然对儿童严重结核具有保护作用,但对于成人肺结核的保护效力差异极大;BCG也不被推荐用于HIV感染的婴儿。基因技术的研发、免疫学和系统生物学研究的进展为新的结核疫苗的研发提供了机遇。
过去的十年中经历了结核疫苗研发的两个阶段,一是研发优于BCG的疫苗或BCG替代疫苗,二是采用初免-加强免疫策略,即在新生儿中使用BCG而在青少年和成人中使用另一种增强型的新疫苗。目前全球进入临床试验的候选疫苗比以往任何时期都多,包括重组BCG疫苗、结核分枝杆菌减毒株、病毒载体疫苗、蛋白/佐剂联合疫苗、结核分枝杆菌提取物。
15种候选疫苗处于临床试验中,大部分为预防性结核疫苗(预防感染或预防潜伏感染后进展为结核病),其中2个为BCG替代疫苗,1个免疫治疗疫苗。
(一)MVA85A
是牛津大学设计、表达结核分枝杆菌Ag85A的病毒载体减毒疫苗,是一种用于BCG初免婴儿的增强型疫苗,已于2009-2012年在南非完成Ⅱb临床试验。将在塞内加尔和南非纳入650名接种BCG、HIV感染者中进行Ⅱ期临床试验,以评价其安全性和免疫原性。该试验结果将于2015年初发布。
(二)M72+AS01e
是GSK研发的蛋白亚单位疫苗,是一种可提高免疫活性的新型佐剂。将由GSK和Areas在南非、肯尼亚和赞比亚等三个结核病高流行国家纳入3600名接种BCG、IGRA阳性且HIV阴性者进行Ⅱb临床试验阶段,以评价两种剂量的疫苗的保护率、安全性和免疫原性。
(三)Crucell Ad35/AERAS-402
是一种用于婴儿、青少年和成人的增强型腺病毒载体疫苗,处于Ⅱ临床试验阶段,以评价其安全性和免疫原性。
(四)蛋白亚单位佐剂疫苗
包括Hybrid 1:IC31、H56:IC31和H4:IC31等三种疫苗,由丹麦哥本哈根血清研究所研发。后两个疫苗正由Areas在非洲进行Ⅱ期临床试验阶段;同时,H4:IC31正在南非的IGRA和HIV均阴性的青少年中进行Ⅱ期研究,以评价其对预防结核分枝杆菌感染的效果。
(五)VPM 1002
是一种活的重组疫苗,最初由Max Planck生物学研究所研发,后续由Vakzine项目管理部门、TBVI和印度血清研究所研发。最近已在南非完成Ⅱa临床试验,评价其安全性和免疫原性的第二阶段Ⅱ期临床试验阶段将在HIV感染的新生儿中进行。
(六)RUTI
是一种用于免疫治疗的灭活疫苗,已在南非完成Ⅱ期临床试验,计划将开展Ⅲ期临床试验。
(七)M. vaccae
中国安徽的一家制药公司研发的疫苗,正在中国的PPD> 15mm的人群中进行Ⅲ期临床试验,以评价其安全性和有效性。VaccaeTM目前已在中国获得标准抗菌治疗佐剂的注册。
(八)处于Ⅰ期临床试验阶段的5种疫苗
1. MTBVAC:由萨拉戈萨大学、巴斯德研究所、BIOFABRI和TBVI共同研发,是第一个进入Ⅰ期临床试验的结核分枝杆菌减毒活疫苗。Ⅰ期临床试验以完成,计划将在新生儿中进行Ⅱ期研究,在青少年和成人中的评价也在考虑之中。
2.ID93+GLA-SE:是一种由新型佐剂GLA-SE构建的重组融合蛋白,由感染性疾病研究所(IDRI)联合Areas公司研发。最近在南非的成人中完成了安全性和免疫原性评价的Ⅰ期临床试验,目前正计划与Areas公司共同进行预防复发的临床试验。
3.Ad5 Ag85A:是一种表达Ag85 的腺病毒,由McMaster大学和一家位于中国天津的生物制品公司共同研发。已完成的Ⅰ期临床试验显示,没有发生与疫苗相关的不良反应,且其免疫原性更强。目前正计划进行安全性和免疫原性评价的Ⅰ期研究。
4.DAR 901:一种热灭活的M. obuense分枝杆菌,由达特茅斯大学和Areas公司共同研发。评价其安全性和免疫原性的Ⅰ期临床试验正在77名接种BCG、HIV感染且未感染结核分枝杆菌的美国人中进行。
5.TB/FLU-04L:是一种重组的流感病毒载体疫苗,由生物安全问题研究所和流感研究所共同研发,并获得国际专家的支持。这一疫苗被设计为可应用于婴儿、青少年和成人的粘膜增强型疫苗。最近已在接种BCG、QuantiFERON TB-Gold阴性的健康成年志愿者中完成了Ⅰ期临床试验,计划将开展Ⅱ期临床试验。
四、研究与发展在2015年后结核病控制策略中的作用
要实现2015年后结核病控制策略中降低死亡率和发病率的目标,需要新工具增强结核病诊断、预防和治疗工作,“增强研究与创新”是2015年后结核病控制策略中提出的三大基础支柱之一,这一内容被进一步分为两个部分,一是新工具、干预措施和策略的探索和发展,二是实施和影响评估的研究。
“研究支柱”是实现2015年后目标以及其他两个支柱所必需的,强调需覆盖所有的领域,包括:
(1) 基础研究:开发新的诊断工作、药物和疫苗
基础研究是研发新工具以改善结核病的治疗和控制,通过这些研究可以更好地了解结核分枝杆菌、细菌与宿主之间的交互作用,为将新技术转化为可应用的产品提供基础。
研究人员正在重新定义结核病、潜伏感染进展为结核病的过程,更好地了解结核分枝杆菌在宿主体内的表现,这些进展有助于更好地掌握病原学、证实与结核病诊断相关的生物标志,也有助于提出新的抗结核药品靶标以及保护免疫力、疫苗有效性和对治疗的反应的早期指标,这些将对新干预措施的选择和评估提供便利条件。
(2)实施性研究:在改善的卫生系统中推广新工具和新策略
需要在国家水平上开展更广泛的工作,进行更多和内容更宽泛的实施性研究来选择最好的措施和创新的工具,例如:获得结核病流行状况和卫生系统覆盖方面的数据。同样的,在国家水平上实施的措施与全球推荐的策略保持一致也是必要的。
附:我国2014年耐多药肺结核疾病负担的计算
1.计算公式 M= 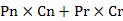
M:总的MDR的发生数;Pn:新患者中MDR率;Pr:复治患者中MDR率;
Cn:登记的新患者数;Cr:登记的复治患者数
2.计算方法
现以2011年为例,估算全国的耐多药肺结核疫情。
根据WHO2014年年报,细菌学确诊新发病例(新涂阳)275915例,临床诊断病例(新涂阴)512469例,肺外结核30767例,细菌学确诊复发病例(复治涂阳)28025例。因此,全国全年可以发现的耐多药数为:
M=新涂阳患者中MDR率×新涂阳患者数+新涂阴患者中MDR率×新涂阴患者数+肺外结核患者中MDR率×肺外结核患者数+复治患者中MDR率×复治患者数
因为,暂无新涂阴患者和肺外结核患者中MDR率的资料,以新涂阳患者中MDR率暂时代替。
=5.71%×275915+5.71%×512469+5.71%×30767+25.64%×28025=53959例,约5.4万例
也就是说,若2014年对全国已登记的活动性肺结核患者进行筛查,大约可以发现53959例患者。